Teremos aqui um desempenho mais alto para o ano letivo.
Bem-vindo a Página de [AIC].
Abaixo estão as Ajudas Iniciais em Ciências:
Ciências 1° Bimestre
Ciências da Natureza:


Ouça o conteúdo:
Ciências da Natureza:
Este é o principal nome para o conteúdo de ciências para o nono ano do ensino fundamental, porém de uma forma organizada são estudados por áreas diferentes separadas por: Biologia, Física, Química, cada um estudando suas grandezas.
-
Biologia: É a ciência que estuda os seres vivos, considerando seus organismos e comparando suas relações, entre si e com o ambiente, como o ambiente é formado por matéria, a biologia está em toda parte.
-
Física: É a ciência que estuda fenômenos da natureza, como movimento, energia, calor, som, luz, eletricidade e magnetismo. Ela é considerada uma ciência básica, pois seus conceitos servem de base para o desenvolvimento de outras ciências e tecnologia, por isso a física está em toda parte.
-
Química: É a ciência que estuda os seres vivos, considerando seus organismos e os fenômenos vitais envolvidos na integração desses fenômenos químicos, ou seja, estuda a matéria, suas propriedades e transformações.
Transformações
Propriedades
Estrutura
Matéria
Toda matéria é composta por átomos que é a menor unidade básica da matéria.
Átomos: Apresentam duas partes fundamentais o núcleo e a eletrosfera.
As partículas, fundamentais, que constituem os átomos são: Prótons, Nêutrons e Eléctrons.
No núcleo do átomo são encontrados: Prótons e nêutrons enquanto que na eletrosfera são encontrados os Eléctrons.
Os átomos por sua vez, reúnem-se em grupos denominados moléculas. No caso da substância água, as moléculas são formadas por dois átomos do elemento Hidrogênio e um átomo do elemento Oxigênio H2O.
Molécula: É a menor porção de uma substância que ainda conserva as propriedades dessa substância.
Quando nos referimos a Matéria, ela também pode ter dimensões limitadas, neste caso, será um corpo. Se o corpo possui finalidade específica teremos um objeto.
Exemplos: A madeira, o vidro e o ferro são matérias ou materiais. Um pedaço de madeira, um caco de vidro, uma barra de ferro são corpos.
Uma cadeira de madeira, um copo de vidro e um portão de ferro são objetos.
Na matéria distinguimos propriedades gerais e específicas.
-
Propriedades Gerais: As propriedades gerais são comuns a todo tipo de matéria e não permitem diferenciar uma matéria de outra.
-
Propriedades Gerais da Matéria: Massa, Volume, Impenetrabilidade, Elasticidade, Compressibilidade e Divisibilidade.



Explicações Gerais:
Corpo: é o mesmo que qualquer objeto, em física.
Massa: pode-se definir massa como a quantidade de matéria de um corpo.
Volume: propriedade que a matéria tem de ocupar lugar no espaço.
Impenetrabilidade: Propriedade da matéria em que dois corpos não podem ocupar, ao mesmo tempo, o mesmo lugar no espaço.
Elasticidade: Capacidade que a matéria tem de retomar seu volume inicial, uma vez cessada a força que causa a sua modificação.
Compressibilidade: Propriedade que a matéria possui de reduzir seu volume quando sujeita a certas pressões.
Divisibilidade: Capacidade de a matéria ser dividida em porções cada vez menores até chegar em uma molécula, que é a menor unidade de uma determinada substância.
Principais Unidades de Medida de Massa:
Miligrama (mg) 1 mg = 0,001 g
Grama (g) 1 g = 1000 mg
Quilograma (kg) 1 kg = 1000 g
Tonelada (t) 1 t = 1000 kg
Unidade
Litro
Mililitro
Centímetro cúbico
Símbolo
L
ml
cm³
Relação entre unid.
1l=1000ml=1000cm³
1ml=1cm³
Exercícios Indisponíveis
Ciências 2° Bimestre
Revisão Substâncias e Misturas:


Substâncias e Misturas:
Luz e Som
São tipos de energia e se propagam através de ondas...
O espaço é um grande vácuo que é uma propriedade onde o som não pode se espalhar.
-
A luz se espalha em formas de ondas e conseguem se espalhar pelo vácuo.
Substâncias
-
Substâncias apresentam composições químicas definidas.
Geralmente são criadas pela própria natureza, sem que o homem interfira.
Exemplos de Substâncias:
H2O = Água Fe2 = Barra de Ferro
CO2 = Dióxido de Carbono Al2 = Barra de Alumínio
NaCL = Cloreto de Sódio H2 = Gás Hidrogênio
H2O2 = Água Oxigenada CO3 = Trióxido de Carbono
O3 = Gás Ozônio O2 = Oxigênio
C6H12O6 = Glicose
Misturas
Mistura o homem cria a partir de substâncias já criadas.
-> Substâncias é união de elementos químicos, com fórmula definida.
Substâncias Simples e Compostas
-
Substância Simples: é uma substância simples aquelas que são formadas por um único elemento químico.
Ex.: Oxigênio+Oxigênio = Gás Oxigênio, fórmula O2.
Molécula de gás oxigênio = substâncias simples.
-
Substância Composta: são aquelas formadas por mais de um elemento químico.
Ex.: 2 hidrogênios+Oxigênio = Água, fórmula H2O.
= Molécula de água.
Misturas Homogêneas e Heterogêneas
-
Misturas Homogêneas: são acrescentadas substâncias e após o processo mecânico e o passar do tempo, não conseguimos mais identificar as substâncias iniciais.
Exemplos: Massa de pão, suco natural, café com leite, água e sal.
-
Misturas Heterogêneas: mesmo com a ação mecânica as substâncias não se misturam e podemos perceber nitidamente as substâncias.
Exemplos: Água e óleo, Nescau, água+tinta.
Relembrando:
Átomo: é o elemento químico isolado.
Molécula: é a menor unidade da substância.
Exercícios Indisponíveis
Ouça o conteúdo:
Ciências 3° Bimestre
Elementos Químicos:


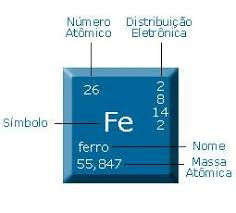
Número Atômico:
Os diferentes tipos de átomos (elementos químicos) são identificados pela quantidade de Prótons (P) que possui. Esta quantidade de prótons recebe o nome de número atômico, sendo representado pela letra Z.
Z=P Verifica-se que em um átomo o número de Prótons é igual ao número de Elétrons (representado por e)
Número de Massa (representado por A). Outra grandeza muito importante nos átomos é seu número de massa (A), que corresponde à soma do número de prótons (Z ou P) com o n° de Nêutrons (N).
Sendo assim: A=Z+N
Para calcularmos o Número de Nêutrons usamos N=A-Z.
A Eletrosfera:
Na eletrosfera, os elétrons transitam de acordo com uma trajetória fechada em torno do núcleo ocupando, regiões denominadas níveis de energia ou camadas eletrônicas. Esses níveis são designados pelos números inteiros de 1 a 7 ou pelas letras maiúscula K, L, M, N, O, P, Q. Respectivamente.
Todos os átomos de determinado elemento químico tem o mesmo número atômico (Z) mas eles podem diferir entre si de alguma maneira.
Átomos que tem o mesmo número atômico mas diferentes números de massa são denominados Isótopos. Por exemplo:
>Isótopos: são o mesmo elemento, porém os Números de Nêutrons (N) e Números de Massa (A) são diferentes.
>Isóbaros: os elementos são diferentes, porém o Número de Massa (A) são iguais.
>Isótonos: são elementos diferentes, porém os Nêutrons (N) são iguais.
Usamos as seguintes fórmulas para:
*A=Z+N para descobrir o número de massa
*e=Z para descobrir o número de elétrons
*N=A-Z para descobrir o número de nêutrons